Публикация в журнале "Экология и промышленность России"
Ежемесячный общественный научно-технический журнал “Экология и промышленность России”, выпуск за май 2009 г..
Развитие популяций бактерий Lactococcus lactis SSP. lactis на агаризованных средах, моделирующих естественный субстрат.
М.А. Тренина, Д.А. Складнев, С.В. Бронников, Е.А. Устюгова, Л . Г. Стоянова
Работа частично финансировалась по гранту РФФИ М 06-04-48235.
Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов, Московский государственный университет прикладной биотехнологии, МГУ им. М.В. Ломоносова.
Среди современных проблем биологии центральное место занимает проблема адекватного экологического прогноза, а микробиологии — проблема строгого количественного предсказания численности видов, образующих сообщество как функции, аргументами которого являются факторы, определяющие жизнеспособность микроорганизмов. Молочнокислые бактерии известны с глубокой древности. Развитие микробиологии резко расширило области применения этих микроорганизмов. На основе их использования возникли крупные промышленные предприятия по производству молочных, мясных и рыбных продуктов питания, молочной кислоты, полимеров, декстранов как плазмозаменителей для медицинской промышленности, а также кормов растительного происхождения. В последние годы наблюдается возросший интерес к этой группе микробов в связи с их способностью синтезировать антимикробные вещества — бактериоцины, используемые в качестве биоконсервантов для получения экологически чистых продуктов питания и пищевого сырья.
Сравнительное изучение свойств лактококков разного происхождения позволило сделать вывод о более разнообразном наборе ферментных систем для утилизации сахаров и большей устойчивости к стрессам лактококков, выделенных из смывов с растений, по сравнению с бактериями того же вида, выделенных из молока [1]. Процесс развития популяций лактококков происходит в условиях сильного селективного давления, заставляющего каждую отдельную клетку расти и делиться как можно быстрее. Эффективное деление бактерий возможно при наличии в питательной среде источников углерода и азота.
В настоящее время известно, что бактерии вида L. lactis обладают особыми механизмами утилизации источников азота, которые являются причиной двухфазного роста лактококков в молоке [2]. Мутанты лактококков, не способные усваивать (транспортировать) олигопептиды, очень плохо растут в молоке. В то же время если нарушен транспорт ди- и три-пептидов, то мутантные клетки делятся так же, как и клетки дикого типа. Ограниченное количество олигопептидов необходимого размера (от 4 до 10 — 12 аминокислотных остатков) является причиной того, что их недостаток после первой фазы логарифмическо-го роста приводит к снижению темпа или остановке деления клеток за счёт стресса при голодании [2]. Последующая активизация деления клеток связана с включением работы генов протеолитической активности и образованием новых олигопептидов. Несомненный интерес представляет в этой связи изучение процессов утраты родительских генов и упрощения метаболизма клеток или увеличение копийности генов (дупликации и амплификации) в условиях селекции по определённому признаку, например дупликация гликолитических генов у бактерий L. lactis штамма I11403 [4]. Рассмотрим развитие бактериальных популяций L. lactis дикого штамма 729 и гибридного бактериоцинобразующего штамма F-116, полученного слиянием протопластов двух родственных штаммов – 729 и его мутанта, отобранного после комбинированного воздействия ультрафиолетовых лучей и этиленимина [5], в средах, приближенных по составу к коровьему молоку как естественному субстрату их обитания и отличающихся по уровню обогащения. Штаммы генотипированы: 729 – EF-100778, F-116 – EF-100777.
Сравнительное определение размера бактериальных колоний на агаризованных средах разного состава и динамики развития бактериальных популяций в жидкой питательной среде М5-G с глюкозой осуществляли после предварительной подготовки клеток для проведения экспериментов. С этой целью бактерии дважды пересевали на специализированные агаризованные среды (табл. 1). Для адаптации бактерий к минимальному составу использовали агаровую среду МА4-G, а для адаптации их к обогащённому субстрату – среду МА6-G. Среды МА5-G, МА5-L и М5-G содержали стимулирующие рост компоненты (дрожжевой экстракт), на фоне лимита по источникам азота (пептон из казеина) и углерода (глюкоза или лактоза). Бактерии L. lactis штаммов 729 и F-116 рассевали при помощи шпателя на поверхности агаризованной среды, находящейся в стандартной чашке Петри (диаметр 10 см), таким образом, чтобы после их инкубирования в течение 24 ч при 30 °С получали неслившиеся отдельные колонии. На каждую из шести чашек Петри, содержащих среды МА4-G, МА5-G и МА6-G и МА4-L, МА5-L и МА6-L, были рассеяны две линии штаммов – 729 и F-116, адаптированных к минимальному и обогащённому питательным субстратам. Далее оценивали диаметр бактериальных колоний (табл. 2) и определяли их размер с учётом стандартного отклонения на сканированном изображении их внешнего вида на поверхности агаризованных сред (рис. 1 и 2).
Отдельные мелкие и крупные колонии с каждого представленного рассева были “отколоты” (при помощи стеклянной палочки образец клеток из колонии перенесён на поверхность новой агаризованной питательной среды) и рассеяны при помощи микробиологической петли сначала на среде МА6-G, а затем – на средах: МА5-G и МА5-L. Такая схема пересева лактококков позволила обнаружить различие в эффективности роста клонов, полученных на средах с лактозой. Несколько таких клонов было отобрано, перепроверено и заложено в коллекцию (хранение при -20 °С в 40 %-ном глицерине). Один из отобранных клонов, обозначенный F-116-1, изучали с точки зрения динамики развития культуры по сравнению с родительским штаммом 729.
Таблица 1. Состав специализированных питательных сред, %
| Компонент | MA4-G | MA4-L | MA5-G | MA5-L | MA6-G | MA6-L | M5-G |
|---|---|---|---|---|---|---|---|
| Пептон из казеина | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 |
| Дрожжевой экстракт | - | - | 0,2 | 0,2 | 0,4 | 0,4 | 0,2 |
| Мясной экстракт | - | - | - | - | 0,4 | 0,4 | - |
| Лактоза | - | 0,4 | - | 0,4 | - | 0,5 | 0,4 |
| Глюкоза | 0,4 | - | 0,4 | - | 0,5 | - | - |
| Агар | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | - |
| Na2HPO4 | 0,85 | 0,85 | 0,85 | 0,85 | 0,85 | 0,85 | - |
| KH2PO4 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | - |
Примечание. Остальное – вода.
Таблица 2. Размеры колоний штамма F-116 на питательных средах с лактозой и глюкозой, мм
| Колонии | MA4-L (с лактозой) | MA5-L (с лактозой) | MA6-L (с лактозой) | MA4-G (с глюкозой) | MA5-G (с глюкозой) | MA6-G (с глюкозой) |
|---|---|---|---|---|---|---|
| Крупные | 0,8-1,0 | 1,0-1,2 | 1,2-1,6 | 0,8-1,0 | 1,0-1,1 | 1,0-1,2 |
| Мелкие | 0,3-0,5 | 0,5-0,8 | 0,8-1,0 | - | - | - |
Примечание. Знак “ “ означает, что гетерогенности клонов не обнаружено.

Рис. 1. Внешний вид колоний L. lactis F-116 на агаризованных питательных средах: а, б, в – МА4-L, МА5-L, МА6-L; г, д, е – МА4-G, МА5-G, МА6-G (см. табл. 1)
Выращивание бактерий обоих штаммов проводили в минимальной жидкой питательной среде М5-G после их предварительной адаптации на среде МА5-G. Исходный титр бактерий в среднем составлял ~ 6,6Ч106 кл/мл. Высев бактериальных суспензий проводили на обогащённую МА6-G и обедненную МА5-G среды через каждый час в течение первых трёх часов инкубирования при 30 °С. Уровень накопления биомассы оценивали на основании количества колоний, образованных на поверхности среды МА6-G, с учётом исходного разведения бактериальной суспензии. Начало изменения физиологического состояния бактерий в период стресса при голодании по источнику азота тестировали на среде МА5-G.
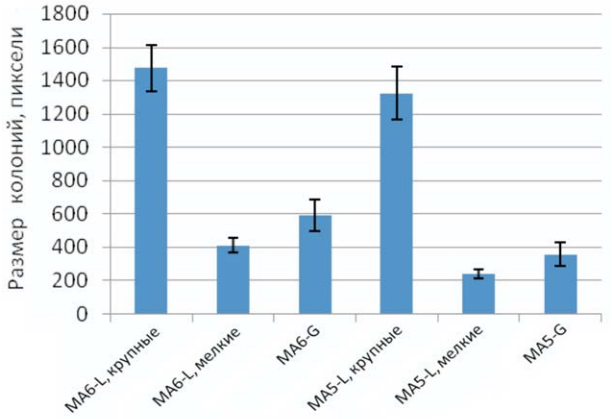
Рис. 2. Размеры бактериальных колоний L. lactis F-116, полученные в результате статистической обработки визуального изображения колоний, представленных на рис. 1 (б, в, д, е), с использованием компьютерной программы CellProfile
Оценка размеров колоний L. lactis subsp. lactis штамма F-116
Внешний вид бактериальных колоний штамма F-116 показан на рис. 1. Размеры крупных и мелких бактериальных колоний на средах с лактозой (рис. 1, а – в) и глюкозой (рис. 1, г – е) приведены в табл. 2. Размеры бактериальных колоний, выраженные в пикселях, полученные в результате статистической обработки визуального изображения колоний, представленных на рис. 1, б, в, д, е, показаны на рис. 2.
Из приведенных данных видно, что средний размер колоний на обогащенной среде, содержащей мясной экстракт (МА6-G), больше, чем на минимальной среде МА5-G, в 1,7 раза. Различие в размере крупных колоний на средах МА5-L и МА6-L, содержащих лактозу, не является статистически достоверным. Однако на тех же средах (МА5-L и МА6-L) различие в размере мелких колоний составляет ту же величину. Полученные результаты свидетельствуют о наличии фенотипической гетерогенности популяции клеток лактококков, проявляющейся в различии размера формируемых бактериальных колоний, только в случае присутствия в питательной среде лактозы, а не глюкозы. Данный эффект расщепления, морфологически однородной по размеру колоний популяции на два типа, обнаружен только в случае предварительного выращивания бактерий на обогащённой среде МА6-G, содержащей мясной экстракт, но не на минимальной среде МА4-G. Возможным объяснением этого является индуцибельный характер использования данного углевода лактококками и в связи с этим более сложный регуляторный механизм преодоления стрессовых условий, вызванных голоданием по источнику азота в процессе развития колоний (рис. 3).
Все варианты клонов, слабо растущих на среде МА5-L (8 клонов), полученные из мелких колоний, утратили способность сквашивать молоко в отличие от клонов, полученных из рассева крупных колоний (см. рис. 1, а – в). Однако отсутствие способности сквашивать молоко, содержащее лактозу в качестве основного источника углерода, у клонов, полученных из мелких колоний, не означает утрату способности образовывать колонии на питательных средах, содержащих лактозу в качестве единственного источника углерода. По-видимому, в данном случае имеет место не полное нарушение функции сбраживания лактозы, однако оно является критичным для наличия у бактерий способности сбраживать молоко. Этот признак обозначим Lacli. Проявление данного признака наблюдается у лактококков в большей степени на среде МА5-L, в которой минимальное количество пептона из казеина и лактозы (по 0,4 %) дополняется стимулирующей деление клеток добавкой дрожжевого экстракта (0,2 %). В обогащённой среде МА6-L, содержащей мясной экстракт, этот признак либо не проявляется, либо проявляется в случае высокой плотности посева.
Развитие бактериальных популяций штамма 729 и штамма F-116-1 в жидкой питательной среде М5-G
Сравнение динамики развития бактериальных популяций исходного штамма 729 и штамма F-116-1 (обладающего фенотипом Lac li) проводили в жидкой питательной среде М5-G (см. табл. 1) в течение первых трёх часов инкубирования (рис. 4). За это время увеличение титра бактерий штамма 729 составляло в среднем 23,9 раза. За первый час инкубирования титр клеток увеличился в 3 раза. При этом среднее время удвоения составляло 39,5 мин на обогащённой среде МА6-G и 39 мин – на обедненной среде МА5-G. Это свидетельствует о том, что количество клеток, выросших на обогащённом и на минимальном субстратах, практически одинаковое в течение первого часа инкубирования клеток в жидкой среде М5-G. При дальнейшем инкубировании бактерий штамма 729 наблюдалось увеличение среднего времени удвоения до 46 мин, тестируемое на обогащенном субстрате (среда МА6-G), и до 54,6 мин – на минимальном субстрате (среде МА5-G), что указывало на замедление темпа деления клеток. Это можно объяснить как следствие изменения физиологического состояния клеток в процессе замедления темпа их деления и уменьшения числа клеток популяции, способных образовывать колонии на минимальной агаризованной среде МА5-G. Общее увеличение количества колоний на среде МА5-G за три часа инкубирования составляло в среднем 17,1 раза, что меньше, чем этот же показатель, определённый при росте на обогащённой среде МА6-G в 1,4 раза. Таким образом, можно предположить, что в течение первого часа деления бактерий штамма 729 в среде М5-G клетки не подвергались стрессовому воздействию и способны были образовывать колонии с одинаковой эффективностью как на обогащённом, так и на минимальном субстратах. Дальнейшее развитие бактериальных популяций в среде М5-G, повидимому, сопряжено с необходимостью преодолевать неблагоприятные воздействия внешней среды.
Иначе происходило развитие бактериальных популяций штамма F-116-1, обладающего фенотипом Lacli, в тех же условиях, т.е на жидкой среде М5-G. Среднее время удвоения, равное 32 мин, при тестировании на обогащённом субстрате (среда МА6-G) наблюдалось только на третьем часу инкубирования бактериальных суспензий, тогда как в течение первых двух часов клетки делились очень медленно (рис. 4). Высев образцов растущей бактериальной суспензии проводили через каждый час на среды МА6-G и МА5-G.

Рис. 3. Внешний вид колоний L. lactis F-116-1 (а, в) и штамма 729 (б, г), на питательных средах МА5-G (а, б) и МА6-G (в, г)
Время удвоения, тестированное на среде МА5-G, составляло в среднем 36,4 мин. Следовательно, также как в случае штамма 729, количество колоний, образованных на минимальной среде МА5-G штаммом F-116-1 после высева их на третьем часу инкубирования из жидкой среды М5-G, было меньше, чем на обогащённой среде МА6-G. Однако приблизительные диаметры “зрелых” колоний этих штаммов (см. рис. 3) составили, мм: 1,5 – 2,0 (а), 1,0 – 1,5 (б), 2,0 – 3,0 (в) и 1,5 – 2,0 (г). Это указывает на больший размер колоний штамма F-116-1 как на среде МА5-G (см. рис. 3, а и б), так и на среде МА6-G (см. рис. 3, в и г). Следовательно, развитие популяций штамма F-116-1, обладающего фенотипом Lacli, имеет преимущество в эффективности роста на более поздних стадиях развития по сравнению с исходным штаммом 729 и характеризуется существенно более длинной лаг-фазой. Возможно, большую прозрачность периферийной области “зрелых” колоний исходного штамма 729 по сравнению со штаммом F-116-1 (см. рис. 3) можно объяснить частичной гибелью клеток этого штамма в неблагоприятных условиях позднего развития популяции.
Реакцию бактерий на экстремальные воздействия принято оценивать снижением скорости роста и жизнеспособности клеток [6]. Было проведено сравнение динамики развития бактериальных популяций трёх родственных штаммов L. lactis, имеющих различные свойства. Обнаружено, что неоднородность популяции гибридного штамма F116 [5], выражающаяся в гетерогенности размера бактериальных колоний, наблюдается только в случае присутствия лактозы и после предварительного культивирования бактерий на обогащённой мясным экстрактом среде МА6-G. По-видимому, важным фактором, обусловливающим данный эффект, является смена источника углерода, глюкозы на лактозу, утилизация которой осуществляется индуцибельным gal-опероном. Однако неоднородность популяции гибридного штамма F-116 в тех же условиях переноса клеток на среду с лактозой не наблюдается при предварительном культивировании бактерий на минимальной среде МА4-G. Следовательно, процессы, приводящие к расщеплению однородной популяции лактококков, являются энергоемкими и требуют обогащения среды культивирования для их последующего роста и развития. Среды, состав которых представлен в табл. 1, содержащие гидролизованный казеин в качестве источника азота, что приближает их к пептидному составу натурального коровьего молока, в настоящей работе имели три функциональных назначения. Минимальную среду МА4(-G,-L), содержащую по 0,4 % источников азота и углерода, использовали в том случае, когда не требовалась интенсификация деления бактерий, которая достигалась добавлением небольшого количества дрожжевого экстракта (0,2 %) в среде МА5(-G,-L), и обогащение среды при увеличении концентрации питательных компонентов и добавления мясного экстракта в среде МА6(-G,-L) (см. табл. 1). Размер бактериальных колоний увеличивался по мере обогащения среды (см. рис. 1 и 2, табл. 2), что указывало на недостаток питания при остановке деления клеток в процессе формирования колоний. Возможный механизм осуществления процессов, приводящих к неоднородности свойств клеток популяции лактококков, может базироваться на концепции адаптивной гомологичной рекомбинации, исследованной на примере бактерий Escherichia coli [7]. Эта концепция, опираясь на новую гипотезу механизма гомологичной рекомбинации, реализующуюся в стрессовой ситуации, объясняет возникновение у бактерий новых свойств, необходимых для выживания микроорганизмов при изменении условий внешней среды.

Рис. 4. Уровень накопления биомассы бактериями L. lactis штаммов 729 и F-116-1 в течение трёх часов инкубирования в жидкой питательной среде М5-G
Особенности утилизации гидролизованного казеина и двухфазная динамика развития популяции лактококков в молоке и в искусственных питательных средах [2] предполагает преодоление клетками периода, связанного с голоданием в результате нехватки азота. Авторы предполагают (на основании изучения размера и плотности бактериальных колоний штамма F-116-1, обладающего фенотипом Lacli), что жизнеспособность его клеток в неблагоприятных условиях позднего развития популяции выше, чем у исходного штамма 729. Нарушение способности сквашивать молоко бактериями штамма F116-1, при частичном сохранении свойства утилизировать лактозу, по-видимому, вызвано изменениями регуляторных функций, которые влияют на уменьшение эффективности образования молочной кислоты. Так, известно, что делеция генов, кодирующих белки HPr и CcpA, которые позитивно регулируют гликолитическую активность (las-оперон) и негативно – ключевые пути метаболизма, например gal-оперон, обусловила отсутствие реакции лактококков на холодовой шок, выражающейся в норме повышением гликолитической активности в 2,5 раза [8]. Эти данные, а также увеличение синтеза белков HPr и CcpA в 2 – 3 раза при стрессе в условиях охлаждения свидетельствуют, что в этом случае происходит включение системы регуляции, активизирующей гликолитическую активность. Возможно, наблюдаемое нами снижение гликолитической активности, проявляющееся в неспособности бактерий штамма F-116-1 сбраживать молоко и уменьшении эффективности роста на агаризованных средах с лактозой, является следствием работы иной регуляторной системы, которая приводит к предпочтительной реализации других жизненно важных функций, а именно, способности сохранять жизнеспособность при стрессовой ситуации. Аналогичное снижение уровня кислотообразования описано ранее [9] при изучении внутривидовой вариабельности бактерий вида L. lactis по признаку адаптации к высокой кислотности среды.
Литература
- Nomura M., Kobayashi M., Narita T., Kimoto-Nira H., Okamoto T. Phenotypic and molecular characterization of Lactococcus lactis from milk and plants // J. Appl. Microbiol. 2006. V. 101.
- Juillard V., Le Bars D., Kunji E.R.S., Konings W.N., Gripon J.-C., Richard J. Oligopeptides are the main source of nitrogen for Lactococcus lactis during growth in milk. Appl. Environ. Microbiol. 1995. V. 61. N 8.
- Burne R.A., Bessen D.E., Broadbent J.R., Claverys J.-P. The seventh international conference of the genetics of streptococci, lactococci, and enterococci // J. Bacteriol. 2007. V.189. № 4.
- Jamet E., Ehrlich S.D., Duperray F., Renault P. Study of duplicated glycolytic genes in Lactococcus lactis IL1403 // Lait. 2001. V. 81.
- Стоянова Л.Г., Егоров Н.С. Получение низинпродуцирующих штаммов методом слияния протопластов двух родственных штаммов Lactoсоссus lасtis subsp. lactis, низкоактивных по синтезу низину // Микробиология. 1998. Т. 67. № 1.
- Николаев Ю.А. Внеклеточные факторы адаптации бактерий к неблагоприятным условиям среды // Прикладная биохимия и микробиология. 2004. Т. 40. № 4.
- Суходолец В.В. Неравный кроссинговер – путь адаптивной гомологичной рекомбинации между прямыми повторами ДНК в тандемных дупликациях у к Esherichia coli // Генетика. 2004. Т. 40. № 8.
- Wouters J.A., Kamphuis H.H., Hugenholtz J., Kuipers O.P., de Vos W.M., Abee T. Changes in glycolytic activity of Lactococcus lactis induced by low temperature // Appl. Environ. Microbiol. 2000. V. 66. №. 9.
- Тренина М.А., Лысенко А.М., Ахвердян В.З., Мчедлишвили Е.Б. Изучение внутривидовой вариабельности бактерий Lactococcus lactis по признаку адаптации к высокой кислотности среды // Микробиология. 2006. Т. 75. № 1.